2025.06.13
【プレスリリース】生命がもつ時計の「0.1ナノメートルの針」が動く瞬間 ―時計タンパク質 KaiC のリン酸化反応メカニズムの解明―
概要
自然科学研究機構分子科学研究所の古池美彦助教、尾上靖宏研究員、斉藤真司教授、秋山修志教授、九州大学先導物質化学研究所の森俊文准教授らの研究グループは、生物が体内で時間を計る仕組みである「体内時計」では、「時計の針」を動かすかのように化学反応の進み具合を調節するタンパク質のメカニズムが働いていることを解明しました。本研究は、「タンパク質に秘められた、化学反応をあえて止めたりタイミングを見計らって進めたりする仕組み」を解明する学問的意義が極めて高い研究成果です。
本研究は、米国科学アカデミーが発行する国際学術誌「PNAS Nexus」に、2025年4月28日に掲載されました。
1. 研究の背景
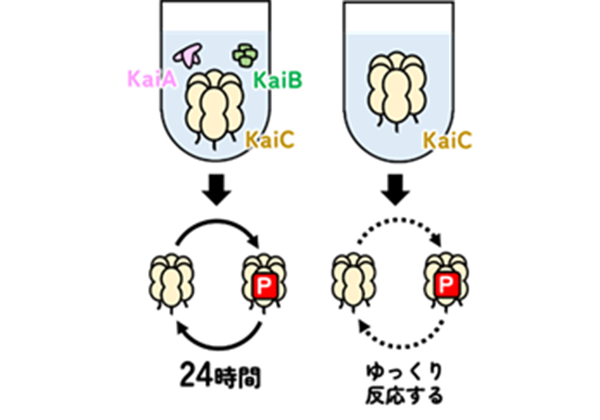
生命は、地球の自転が生み出す約24時間周期の環境変化に適応するための「時間を計る仕組み」を持っています。この仕組みは「体内時計(1)」と呼ばれるシステムで、バクテリアから哺乳類まで多くの生物種に共通してみられるものです。現在のところ、体内時計をかたちづくるのに必要な全ての分子(=部品)が判明している生物種は、光合成生物であるシアノバクテリア(2)のみです。シアノバクテリアがもつ3種の時計タンパク質KaiA、KaiB、KaiCを試験管内で混ぜ合わせると、「リン酸」という物質がKaiCに結合し(=リン酸化(3)と呼ぶ)、また一定時間ののちにリン酸がKaiCから外れる(=脱リン酸化(3)と呼ぶ)化学反応が繰り返し起こります。この時計の針のように時刻の目安となるリン酸化・脱リン酸化のサイクルが、まさに約24時間で1周するということが知られていました(図1左)。しかしながら、どのようにリン酸がKaiCに結合するのか(=時計の針が動くのか)は分かっていませんでした。
2. 研究の成果
研究グループは、KaiA・KaiBの作用を受けながら時計として機能しているときのKaiCではなく、KaiA・KaiBと混合しない条件でKaiCのみに着目することにしました(図1右)。この一見時間を計っていないように見える単独状態のKaiCにはリン酸を結合する能力がないのではないか、とこれまでは考えられていました。本研究を通して、研究グループは非常にゆっくりながらもKaiCがリン酸を結合できることを突き止めました。これはKaiAやKaiBが混在する複雑な条件ではなく、KaiCのみが存在するシンプルな環境でリン酸の結合、すなわち針が動くメカニズムを調べることができることを示していました。
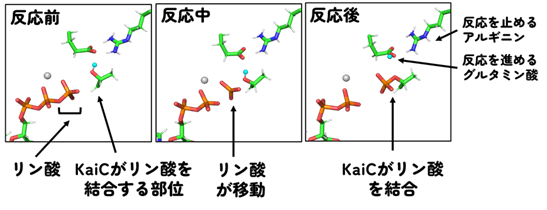
そこでX線結晶構造解析という手法で明らかにしたKaiCの0.1ナノメートルレベルの内部構造を調べ、リン酸が結合する過程を観察すればそのメカニズムが解き明かせると考えました。研究グループは、計算機内でKaiCとリン酸の結合過程を再現することを試み、分子シミュレーション(4)によって、リン酸とKaiCが互いに動きながら徐々に近づいていく様子を調べました(図2)。リン酸がKaiCに結合する過程を詳細に解析したところ明らかになったのは、KaiC内部に存在するグルタミン酸やアルギニンといったアミノ酸の配置の変化がリン酸結合の合図になっているということでした(図2右)。すなわちKaiCには「針を止めておき、タイミングを見計らって針を動かす」ようなメカニズムが備わっていたのです。
シアノバクテリアの時計タンパク質KaiCのリン酸化にとどまらず、必要なときに化学反応を進め、また不要なときには止めておくといった仕組みは、ヒトを含むあらゆる生物の細胞内にあるタンパク質にも備わっている可能性があります。本研究の成果は、タンパク質など生命を構成する分子に秘められた精巧なタイミング制御の一端を解き明かすものです。
3. 研究の意義・応用
- 他の種類の生物の体内時計には、KaiA、KaiB、KaiCとは異なる別種のタンパク質がかかわっていますが、それらの多くもKaiCと同様にリン酸化反応を起こします。本研究は体内時計に共通するメカニズムの理解を進めるものです。
- タンパク質のリン酸化反応は、種々の疾患と深いかかわりがあると考えられており、治療薬の開発等に重要な基礎的な知見を与えるものです。
- 反対にリン酸がKaiCから外れる脱リン酸化反応については詳細なメカニズムは分かっておらず、今後の研究課題として残されています。
4. 用語解説
(1)体内時計:
生命が時間をはかる仕組み。バクテリア、昆虫、植物、哺乳類など多くの生物が有している。体内時計を構成する部品となる分子(時計遺伝子や時計タンパク質)は生物種によって異なっているが、「約 24 時間周期を測る・温度が変わっても影響が小さい・環境変化に同調できる」という点では共通した特徴を持っている。体内時計はヒトの健康を左右することが分かってきており、医療などの分野でも注目されている。
(2)シアノバクテリア:
酸素発生型光合成をおこなう細菌であり、細胞がばらばらに存在する単細胞性のものや細胞が連なって存在する糸状性の種が知られている。
(3)リン酸化・脱リン酸化:
リン酸化は、タンパク質の特定の箇所にリン酸が結合する反応のこと。脱リン酸化は、リン酸化で結合したリン酸がタンパク質から解離する反応のこと。リン酸化・脱リン酸化はタンパク質の立体構造を変化させることができるため、オン・オフなど機能調節の必要があるタンパク質で起こる反応である。
(4)化学反応の分子シミュレーション:
実験では追跡できないような細かく速い化学反応の様子を、計算機を用いてシミュレーションするアプローチ。量子力学と古典力学、分子動力学などの理論化学の計算手法を組み合わせることで、化学反応が進行する様子の可視化や、化学反応に必要なエネルギーの算出が可能となる。
5. 論文情報
6. 研究グループ
- 自然科学研究機構 分子科学研究所
- 総合研究大学院大学
- 九州大学
7. 研究サポート
本研究は、日本学術振興会(JSPS)(22H04984、24H02301、22K19279、23H02448、22K15051、22H02035、23K23303、23KK0254、24K21756、25H02464、21H04676、23K17361)、武田科学振興財団、豊秋奨学金の支援の下で実施されました。本研究のコンピュータシミュレーションには、自然科学研究機構岡崎共通研究施設・計算科学研究センター(23-IMS-C111、24-IMS-C105、23-IMS-C196)のスーパーコンピュータを用いました。
8. 研究に関するお問い合わせ先
- 古池 美彦 (ふるいけ よしひこ)
分子科学研究所/総合研究大学院大学 助教
TEL:0564-55-7336
E-mail:furuike@ims.ac.jp - 森 俊文(もり としふみ)
九州大学 准教授
TEL:092-583-7800
E-mail:toshi_mori@cm.kyushu-u.ac.jp
9.報道担当
- 自然科学研究機構・分子科学研究所 研究力強化戦略室 広報担当
TEL:0564-55-7209 FAX:0564-55-7340
E-mail:press@ims.ac.jp - 九州大学 広報課
TEL:092-802-2130 FAX:092-802-2139
E-mail:koho@jimu.kyushu-u.ac.jp - 総合研究大学院大学 総合企画課 広報社会連携係
TEL:046-858-1629
E-mail:kouhou1@ml.soken.ac.jp
