2025.03.31
【プレスリリース】生きた細胞内で「ユークロマチン」と「ヘテロクロマチン」のふるまいを見分ける新技術を開発
概要
ヒトのゲノム(注1)DNAは、クロマチン(注2)として細胞内に収納され、遺伝情報の読み出し(転写)が活発な「ユークロマチン」と、抑えられた「ヘテロクロマチン」に分類されます。しかし、生きた細胞内で両者を識別することはこれまで困難でした。
このたび、情報・システム研究機構 国立遺伝学研究所の南克彦 総合研究大学院大学(総研大)大学院生、仲里佳子 総研大大学院生、井手聖助教(現 東京科学大学 助教)、田村佐知子 テクニカルスタッフ、前島一博 教授のグループは、東光一 助教、黒川顕 教授のグループ、豊田敦 特任教授のグループ、さらに理化学研究所の海津一成 上級研究員、高橋恒一 チームリーダーと共同で、生きた細胞内のユークロマチンとヘテロクロマチンを別々に標識できる新技術「Repli-Histo標識」を開発しました(図1)。この技術を用いて、超解像蛍光顕微鏡(注3)により詳細に観察・解析を行いました。
その結果、ユークロマチンはヘテロクロマチンよりも大きく揺らいでいることが明らかになりました。さらに、ゲノムDNAは、揺らぎの大きな領域から順に複製(コピー)されていくことを発見しました。クロマチンの揺らぎの大きさは、ゲノムDNAの遺伝情報の読み出しやすさとも密接に関係しています。本研究の成果は、DNA上の遺伝情報がどのように複製・読み出されるのかを理解する手がかりを与えるとともに、これらの過程に欠陥をもつ「がん」などの遺伝的疾患の理解にもつながることが期待されます。
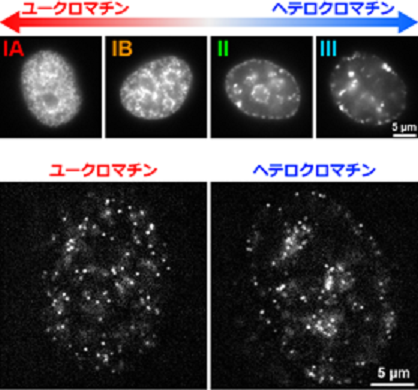
図1:(上)本研究で開発した複製依存的ヒストン標識(Repli-Histo標識)。遺伝情報の読み出し(転写)が活発なユークロマチン(領域IA・IB)と、読み出しが抑制されたヘテロクロマチン(領域II・III)を、それぞれ別々に可視化できる。
(下)超解像蛍光顕微鏡を用いた生きた細胞の核内のヌクレオソーム観察。Repli-Histo標識法により、ユークロマチンとヘテロクロマチンにおけるヌクレオソームの動きをそれぞれ可視化できる(動画1を参照)。白いドットが個々のヌクレオソームを示す。
成果掲載誌
本研究成果は、国際科学雑誌「Science Advances」に2025年3月29日(日本時間)にオープンアクセスとしてオンライン掲載されました。
研究の詳細
- 研究の背景
私たちの体を構成するすべての細胞には、全長約2メートルにも及ぶゲノムDNAが収められています。このDNAは、直径2ナノメートル(注4)の細い糸状の物質であり、「ヒストン」という樽状のタンパク質に巻き付くことで、「ヌクレオソーム」という構造を形成します(図2)。さらに、ヌクレオソームにさまざまなタンパク質が結合し、「クロマチン」と呼ばれる形で細胞内に収納されます。国立遺伝学研究所の前島教授らの研究チームは、2008年よりクロマチンが不規則に凝縮した塊としてダイナミックに細胞内に配置されていることを提唱してきました。
一方、ヒトのゲノムDNAは、クロマチンの機能によって、遺伝情報の読み出しが活発な「ユークロマチン」と、読み出しが抑えられた「ヘテロクロマチン」に分類されます。しかし、これまで生きた細胞内でユークロマチンとヘテロクロマチンをナノメートルレベルで見分け、観察することは困難であり、両者のふるまいの違いについては不明な点が多く残されていました。
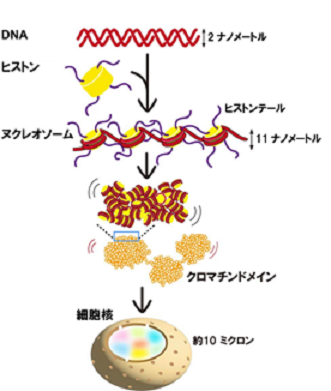
図2: DNAはヒストンに巻き付いてヌクレオソームを形成する。ここでは4個のヌクレオソームを示しているが、1つの細胞には約3,000万個ものヌクレオソーム が存在する。ヌクレオソームは不規則に折り畳まれて塊(クロマチンドメイン)を形成し、細胞核内に収納されている。
- 本研究の成果
本研究では、まず ヒトゲノム上のユークロマチンとヘテロクロマチンを特異的に蛍光標識する技術を開発しました(図1上)。次に、ヌクレオソーム1個1個を観察できる超解像蛍光顕微鏡を駆使し、生きたヒト細胞内で標識したユークロマチンとヘテロクロマチンにおけるヌクレオソームの動きを観察しました(図1下)。
その結果、ユークロマチンはヘテロクロマチンよりも大きく揺らいでいることが判明しました。また、ゲノムDNAはクロマチンの揺らぎが大きな領域から順に複製(コピー)されていくことを発見しました(図3・動画1)。さらに、顕微鏡観察とコンピューターシミュレーションを組み合わせて解析した結果、揺らぎの大きなクロマチンほど、その内部に大きなタンパク質が「アクセス」しやすいことが分かりました(図3・動画2)。これはつまり、クロマチンの揺らぎが大きいほど、遺伝情報が読み出しやすいことを意味します。
本研究の結果は、生きた細胞の顕微鏡観察を通じて得られた新たなクロマチン像です。また、ユークロマチンとヘテロクロマチンという異なる機能を持つ領域で、DNA複製や遺伝情報の読み出しがどのように制御されているのかを、クロマチンの動きの視点から説明する新たな仮説を提唱しました。
- 今後の期待
本研究で開発した技術は、機能の異なるゲノムDNA領域の振る舞いを、ヌクレオソーム1個1個のレベルで観察できる画期的な手法です。この技術を活用することで、細胞内で遺伝情報の読み出しに関わる因子が、どのようにターゲット遺伝子を見つけ、どの遺伝子をいつ発現させるのかといった遺伝子スイッチの仕組みの解明が進むと期待されます。近年、遺伝子発現異常を伴うがん細胞で、クロマチンのふるまいが変化することが明らかになってきました。本研究の成果を応用することで、こうしたクロマチンの異常が関与する「がん」などの遺伝的疾患のメカニズム解明につながることが期待されます。
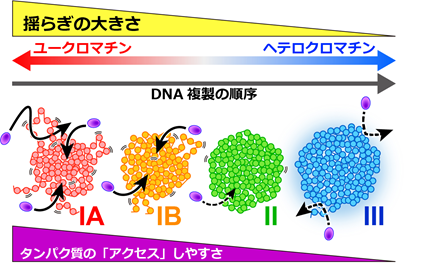
図3: DNAが不規則に凝縮した「塊」(クロマチンドメイン)内でのヌクレオソームの動き。ユークロマチン(IA・IB)はヘテロクロマチン(II・III)よりも大きく揺らいでいる。この揺らぎの大きさは、大きなタンパク質(紫)のクロマチン内部への「アクセス」しやすさや、遺伝情報の読み出しの効率に直接影響を与える。


用語解説
- (注1) ゲノム
生物が持つすべての遺伝情報のセット。 DNA(一部のウイルスではRNA)にコードされている。 - (注2) クロマチン
ヒトの全長約2メートルのゲノムDNAは、「ヒストン」という樽状のタンパク質に巻き付いて「ヌクレオソーム」という構造を作る(図2・上から2段目)。ヌクレオソームはさまざまなタンパク質と結合し、「クロマチン」と呼ばれる形をとって、直径約10ミクロンの「核」の中に収納されている(図2・最下段)。 - (注3) 超解像蛍光顕微鏡
通常の光(可視光)を使った顕微鏡では、200ナノメートル(注4)程度より小さい構造を観察することは難しい(光の回折限界)。超解像顕微鏡はこの限界を超えた、より小さな構造まで観察するための技術である。本研究では、超解像顕微鏡を用い、ヌクレオソームをまばらに蛍光標識することで、超解像を実現し観察を行った(1分子イメージング法)。 - (注4) ナノメートル
1メートルの10億分の1(10⁻⁹)メートル。
研究体制と支援
本研究成果は、国立遺伝学研究所・ゲノムダイナミクス研究室の南克彦 総研大大学院生(元SOKENDAI特別研究員、現 学振特別研究員DC2)、仲里佳子 総研大大学院生、井手聖 助教(現・東京科学大学 助教)、田村佐知子 テクニカルスタッフ、前島一博 教授と、ゲノム進化研究室の東光一 助教、黒川顕 教授、比較ゲノム解析研究室の豊田敦 特任教授、および理化学研究所生命機能科学研究センター の海津一成 上級研究員、高橋恒一 チームリーダーとの共同研究成果です。
本研究は、日本学術振興会(JSPS) 科研費(JP21H02453, JP23K17398, JP24H00061, JP21H02535, JP22H05606, JP23KJ0998)、学術変革領域A「ゲノムモダリティ」(JP20H05936)、JST次世代研究者挑戦的研究プログラム(JPMJSP2104)、武田科学振興財団の支援を受け、おこなわれたものです。「先進ゲノム支援」の協力を受けています(JP22H04925(PAGS))。
